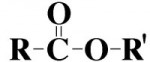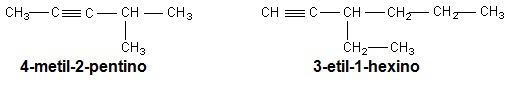sábado, 14 de dezembro de 2013
Reação de adição
REAÇÃO DE ADIÇÃO
As reações de adição são aquelas onde um átomo proveniente de uma substância orgânica ou inorgânica se adiciona à uma substância orgânica. Ocorre em hidrocarbonetos insaturados, como os alcenos e os alcinos.
São caracterizadas pela quebra das ligações duplas e triplas. Nos hidrocarbonetos insaturados, a quebra ocorre na ligação mais fraca (ligação π) e ocorre a formação de duas novas ligações (ligações δ).
São caracterizadas pela quebra das ligações duplas e triplas. Nos hidrocarbonetos insaturados, a quebra ocorre na ligação mais fraca (ligação π) e ocorre a formação de duas novas ligações (ligações δ).
As principais reações de adição são:
- hidrogenação catalítica
- halogenação
- adição de HX
- adição de água
- adição a aromático
- hidrogenação catalítica
- halogenação
- adição de HX
- adição de água
- adição a aromático
Hidrogenação Catalítica
Esta reação de adição ocorre em alcenos e alcinos. O gás hidrogênio é adicionado com a ajuda de um catalisador. Pode ser usado o metal níquel (Ni) ou platina (Pt).
Também podemos chamar esta reação de reação de Sabatier-Senderens.
Na indústria química de alimentos é muito conhecida. Serve de base para a produção de margarinas a partir de óleos vegetais.
Também podemos chamar esta reação de reação de Sabatier-Senderens.
Na indústria química de alimentos é muito conhecida. Serve de base para a produção de margarinas a partir de óleos vegetais.

Os óleos vegetais possuem ligações duplas. A reação de adição, hidrogenação catalítica transforma esses óleos, que são líquidos em gorduras, que é sólida.
Óleo + nH2 → gordura
(líquido insaturado) (sólida saturada) |
Hidrogenação catalítica nos alcenos e alcinos:
Observe que o produto desta reação é um alcano. Então, uma das sínteses de alcanos é a hidrogenação catalítica.
Halogenação
A halogenação é uma reação de adição onde adiciona-se halogênio (Cl2 e Br2) a um alceno ou alcadieno.
Em alceno:

Em alcadieno:

A halogenação forma como produto di-haletos vicinais, ou seja, dois halogênios vizinhos.
Adição de HX (hidrohalogenação)
Esta reação é feita adicionando HX aos alcenos.
HX, onde X é o halogênio.
Exemplos: HCl, HBr
Em alguns casos, obtemos dois produtos. O “teoricamente” esperado deve seguir a Regra de Markovnikov.
Regra de Markovnikov – “Nas reações de adição, o hidrogênio é adicionado ao carbono mais hidrogenado da ligação dupla”.
Esta regra serve somente para o cloro. Para o bromo, serve a regra Antimarkovnikov, que é o inverso daMarkovnikov.
Exemplo de Markovnikov:

Exemplo de Antimarkovnikov:

Adição de Água
Esta reação de adição também é chamada de hidratação de alceno. Ocorre de maneira semelhante com a reação de adição de HX.
É uma reação catalisada por ácido e também segue a regra de Markovnikov. O hidrogênio entra no carbono mais hidrogenado e a hidroxila no carbono menos hidrogenado. Formam como produto, álcool primário e secundário.
Exemplo:
 
Adição a Aromático
Os aromáticos sofrem reações de substituição, porém em alguns casos ocorre uma adição. Quando há hidrogenação total do anel benzênico, a reação é de adição.
Esta reação não é tão fácil de ser feita. Veja o exemplo do hidrogênio se adicionando ao benzeno formando um hidrocarboneto cíclico, o ciclo-hexeno:
Esta reação só é posível se for utilizado o catalisador metálico níquel (Ni) ou platina (Pt) a temperatura de 300°C e com uma pressão de 200atm.
*ESTE CONTEÚDO FOI RETIRADO DO SITE http://www.soq.com.br/conteudos/em/reacoesorganicas/
|
terça-feira, 5 de novembro de 2013
Compostos orgânicos oxigenados
Aqui tem um pdf com todo o assunto de compostos oxigenados, bons estudos.
http://www2.ufersa.edu.br/portal/view/uploads/setores/157/aulasteoricas/Aula.Teorica.06-Compostos.Organicos.Oxigendos.pdf
http://www2.ufersa.edu.br/portal/view/uploads/setores/157/aulasteoricas/Aula.Teorica.06-Compostos.Organicos.Oxigendos.pdf
segunda-feira, 28 de outubro de 2013
Desafio
Esse carinha pegou muita gente no Enem, agora mostre como esta os seus conhecimentos de Química Orgânica e responda essa questão: Onde estão os carbonos quartenários no Nano kid ? Deixe a resposta nos comentários.
sábado, 26 de outubro de 2013
Vídeos aula de FunçõesOrgânicas
Galera, aqui estão o 1 video para ajudar quem quiser se aprofundar em funções. ;)
Funções Orgânicas
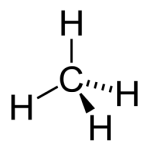
Os compostos orgânicos se diferenciam dos inorgânicos por apresentarem átomos
de carbono distribuídos em cadeias e/ou átomos de carbono ligados diretamente a hidrogênio. Assim, o metano (CH4) é um composto orgânico, mas o ácido carbônico (H2CO3) não.
Os compostos orgânicos podem ser classificados conforme os átomos constituintes, radicais ligantes ou natureza das ligações. Portanto essas características agrupam os compostos por semelhança que formam, assim, as funções orgânicas:
Hidrocarbonetos
São compostos constituídos por, apenas, átomos de carbono e hidrogênio. Sendo essa função composta por uma ampla gama de combustíveis (metano, propano, acetileno).
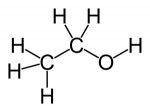
Alcoóis
Os alcoóis são constituídos por radicais de hidrocarbonetos ligados a uma ou mais hidroxilas. Entretanto, nunca podem ser considerados bases de Arrhenius (pois não liberam essa hidroxila em meio aquoso).
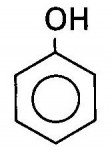
Fenóis
São cadeias aromáticas (hidrocarbonetos) ligados a uma ou mais hidroxilas. Diferindo-se dos alcoóis, portanto, por apresentarem estrutura em anéis rodeados por grupos OH.
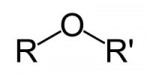
Éteres
São compostos por um átomo de oxigênio entre duas cadeias carbônicas. Sendo estas cadeias também de hidrocarbonetos (radicais alquila ou arila).
Ésteres
São semelhantes aos éteres por possuírem átomos de oxigênio entre as cadeias carbônicas (radicais). Porém, diferem-se destes por possuírem um grupo carbonilo (CO) também entre os carbonos. Assim, a molécula é estruturada por: radical – carbonilo – oxigênio – radical.
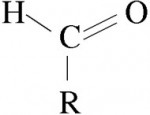
Aldeídos
São formados por um radical orgânico (alifático ou aromático) ligado a um ou mais grupos formilo (HCO).
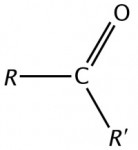
Cetonas
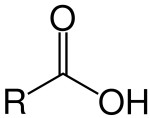
Ácidos carboxílicos
São radicais alquila, alquenila, arila ou hidrogênio ligados a pelo menos um grupo carboxílico (COOH). E, geralmente, são ácidos fracos (liberam poucos íons H+ em meio aquoso).
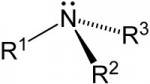
Aminas
São compostos nitrogenados onde até três radicais orgânicos (arila ou alquila) se ligam a um átomo de nitrogênio pela substituição de átomos de hidrogênio da molécula de amônia. De modo que um radical liga-se ao -NH2, dois radicais a -NH e três radicais a -N.
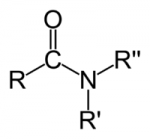
Amidas
São bem parecidas com as aminas, exceto pela presença do grupo carbonilo. Assim, até três radicais acila (RCO) se ligam a um átomo de nitrogênio pela substituição de átomos de hidrogênio do amoníaco. Ou seja, as amidas possíveis são: RCONH2, (RCO)2NH, e (RCO)3N.
Haletos orgânicos
São compostos formados por halogênios (com NOx -1) que substituem átomos de hidrogênio pela reação dehalogenação. É nessa função orgânica que se encontram os CFC (clorofluorcarbonetos).
Exercícios sobre Hidorscarbonetos
Depois de estudar, nada melhor do que exercitar o seu conhecimento com um bom exercício, aqui se tem um um link com algumas questões sobre Hidrocarbonetos com o gabarito no final do deste.
http://www.maximovestibulares.com.br/download/haira/Lista_Quimica_Noturno_QO02_Hidrocarbonetos_Nomenclatura_Haira.pdf
http://www.maximovestibulares.com.br/download/haira/Lista_Quimica_Noturno_QO02_Hidrocarbonetos_Nomenclatura_Haira.pdf
Hidrocarbonetos
Os hidrocarbonetos são compostos orgânicos formados unicamente por carbono e hidrogênio unidos tetraedricamente por ligação covalente assim como todos os compostos orgânicos. Os hidrocarbonetos são a chave principal da química orgânica, visto que são eles que fornecem as coordenadas principais para formação de novas cadeias e posteriormente para nomenclatura de outros compostos. Praticamente todos os alcanos ocorrem naturalmente no gás natural dopetróleo, enquanto que os mais pesados, alcenos e alcinos são obtidos no processo de refinação. Podendo também ser sintetizados em laboratório.
O estado físico dos hidrocarbonetos geralmente é gasoso ou líquido, em virtude de seu baixo ponto de fusão e ebulição, por ser apolares, e unidos por forças intermoleculares fracas, são pouco solúveis em água, ou seja, seu grau de dissociação é bastante pequeno até que seja atingido o equilibrio. Os hidrocarbonetos são subdivididos em alcanos, alcenos e alcinos, podendo ser de cadeias ramificadas, cíclicos ou acíclicos, saturados e insaturados e aromáticos onde:
- Ramificadas: possuem ramificações, que são radicais ligados ao carbono.
- Cíclicos: formam ciclos representados através de formas geométricas.
- Acíclico: são hidrocarbonetos que possuem cadeias abertas
- Saturados: possuem somente ligações simples (σ) sendo saturado de hidrogênios (alcanos e cicloalcanos).
- Insaturados: possuem ligações duplas (σπ) e triplas (σππ), em função destas subtrai-se o hidrogênio (alcenos e Alcinos).
- Aromáticos: são os hidrocarbonetos que possuem o anel benzênico.
Hidrocarbonetos Saturados
Alcanos
São hidrocarbonetos saturados que possuem somente simples ligações em sua formula estrutural. O alcano mais comum é o metano CH4, estando presente não só no gás natural, mas também é produzido bioquimicamente pelos seres microscópicos e que podem viver na ausência de oxigênio, denominados “metanogênios”, presentes noestômago de bovinos e em lamas oriundas de valas oceânicas, sendo capazes de produzir o metano a partir do CO
| Nº de C | Hidrocarboneto | Cadeia carbônica |
| 1 | Metano | CH4 |
| 2 | Etano | CH3CH2 |
| 3 | Propano | CH3 CH2CH3 |
| 4 | Butano | CH3 CH2 CH2CH3 |
| 5 | Pentano | CH3 CH2 CH2 CH2CH3 |
| 6 | Hexano | CH3 CH2 CH2 CH2 CH2CH3 |
| 7 | Heptano | CH3 CH2 CH2 CH2 CH2 CH2CH3 |
| 8 | Octano | CH3 CH2 CH2 CH2 CH2 CH2 CH2CH3 |
| 9 | Nonano | CH3 CH2 CH2 CH2 CH2 CH2 CH2 CH2CH3 |
| 10 | Decano | CH3 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH3 |
Exemplos de alcanos:
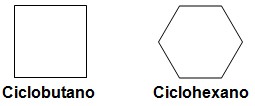
Cicloalcanos
São hidrocarbonetos cíclicos, de cadeia fechada, cujo os átomos de carbono estão ligados entre si e mais 2 hidrogênios.
Hidrocarbonetos insaturados
Alcenos
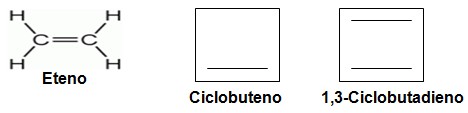
São hidrocarbonetos insaturados que além das ligações simples possuem também ligações duplas, os mais importantes alcenos são o eteno e o propeno, e a produção mundial desses compostos supera os 20 milhões de toneladas anuais. O eteno é encontrado na natureza como hormônio de plantas, além de estar presente em frutas e legumes, está ligado ao amadurecimento destes. O eteno é usado na síntese de diversos outros compostos químicos tais como etanol, óxido de etileno e acetona. É importante lembrar que todo alceno que possui 2 duplas ligações em seu esqueleto carbônico é chamado de alcadieno.
Alcinos
São hidrocarbonetos insaturados que possuem ligações triplas (σ π π), em sua fórmula estrutural. O mais simples dos alcinos é o etino conhecido como acetileno amplamente utilizado na síntese de anticoncepcionais, antifúngicos e como gás de combustão em maçaricos, é um gás altamente inflamável e com odor de alho. Ocorrem naturalmente como hormônios, porém a maioria é sintetizada a partir do petróleo.
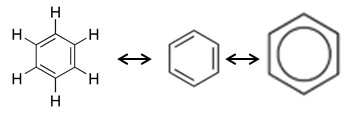
Hidrocarbonetos Aromáticos
São cíclicos e insaturados, que possuem três duplas ligações alternadas no esqueleto carbônico, cujo representante principal e mais simples é o benzeno. Esses hidrocarbonetos são chamados de aromáticos em virtude de possuírem um odor pronunciável. O benzeno é um produto químico muito utilizado, mas vem sendo substituído por outros com devido a seu potencial cancerígeno.
Nomenclatura dos hidrocarbonetos
| Hidrocarboneto | Prefixo de acordo com a quantidade de carbonos. | Terminação |
| Alcano | 1-Met, 2-Et, 3-Prop, 4-But, 5-Pent, 6-Hex, 7-Hept, 8-Oct, 9-Non, 10-Dec, 11-Undec, 12-Dodec, 13-Tridec, 14-Tetradec, 15-Pentadec, 16-Hexadec, 17-Heptadec, 18-Octadec, 19-Nonadec, 20-Icos, 21-Heneicos, 22-Docos, 23-Tricos, 30-Triacont, 31-Hentriacont, 40-Tetracont, 50-Pentacont, 60-Hexacont, 70-Heptacont, 80-Octacont, 90-Nonacont, 100-Hect ... | ano |
| Alceno | eno | |
| Alcino | ino | |
No caso de ciclos: Ciclo + prefixo + terminação
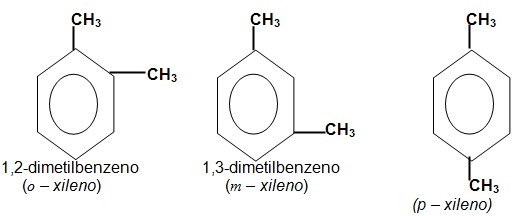
Nomenclatura dos aromáticos
Um sistema antigo de nomenclatura sugere que a posição 1,2(o – orto), 1,3(m- meta e 1,4(p-para) acompanhada de xileno, é usada em função da adição de 2 grupos metila ao anel benzênico origina isômeros (compostos idênticos só diferindo na posição dos radicais).
A nomenclatura comum a todos os aromáticos é:
Numero indicativo de posição dos radicais + nome dos radicais + benzeno
Nomenclatura de cadeias carbônicas
Galera, esse vídeo vai ajudar vocês na hora de fazer a nomenclaturas das cadeias.
quarta-feira, 23 de outubro de 2013
Classificação das Cadeias Carbônicas
A classificação das cadeias carbônicas se dá segundo quatro critérios: o fechamento da cadeia, a disposição dos átomos, os tipos de ligações e a presença de heteroátomos.
1- Quanto ao fechamento da cadeia:
1.1- Cadeia aberta, acíclica ou alifática: uma cadeia aberta é aquela que possui pelo menos duas extremidades ou pontas, não há nenhum encadeamento, fechamento, ciclo ou anel nela. Exemplos:

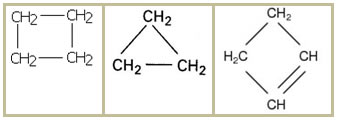
1.2- Cadeia fechada ou cíclica: não possui nenhuma extremidade ou ponta, seus átomos são unidos, fechando a cadeia e formando um encadeamento, ciclo, núcleo ou anel. Exemplos:

1.3- Cadeia mista: apresenta tanto uma parte da cadeia fechada quanto uma parte da aberta. Exemplos:

2 – Quanto à disposição dos átomos de carbono na cadeia carbônica:
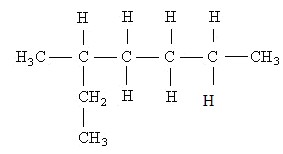
2.1- Cadeia normal, reta ou linear: ocorre quando só existem carbonos primários e secundários na cadeia. Estando em uma única sequência, geram apenas duas extremidades ou pontas. Exemplos:
.jpg)
2.2- Cadeia ramificada: são aquelas que possuem três ou mais extremidades, com carbonos terciários ou quaternários. Exemplos:
.jpg)
3 – Quanto ao tipo de ligação entre os átomos de carbono:
3.1- Cadeia saturada: classificação dada para aquelas cadeias que possuem somente ligações simples entre os carbonos. Exemplos:
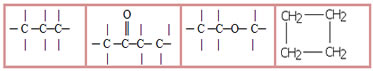
3.2- Cadeia insaturada: cadeias que possuem pelo menos uma ligação dupla ou tripla entre os carbonos. Exemplos:
.jpg)
4 – Quanto à natureza dos átomos que compõem a cadeia carbônica:
4.1- Cadeia homogênea: são aquelas que não possuem nenhum heteroátomo entre os carbonos, ou seja, essas cadeias são constituídas somente por carbonos. Exemplos:
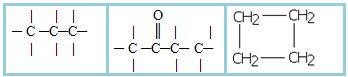
4.2- Cadeia heterogênea: nesse caso há algum heteroátomo entre os carbonos, que normalmente
são o oxigênio (O), o nitrogênio (N), o fósforo (P) e o enxofre (S). Exemplos:
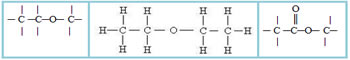
5 – Quanto ao aparecimento de um anel aromático na cadeia carbônica:
5.1- Cadeia aromática: são as que apresentam em sua estrutura pelo menos um anel benzênico, também denominado anel aromático (C6H6). Exemplos:
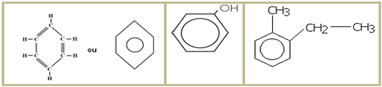
5.2- Cadeia não aromática ou alicíclicas: são as cadeias fechadas que não apresentam um anel benzênico em sua estrutura. Exemplos:
Por Jennifer Fogaça
Graduada em Química
Graduada em Química
Assinar:
Comentários (Atom)
 + 3H2 →
+ 3H2 → 
.jpg)